又到了一年一度的諾獎周,今天是諾獎首日,諾貝爾委員會將生理學或醫學獎授予了三位傑出的科學家,分別是來自美國的瑪麗·E·布倫科、弗雷德·拉姆斯德爾教授,以及日本的坂口志文教授,三人在外周免疫耐受方面取得突出貢獻,獲獎者將平分1100萬瑞典克朗(約合832萬元)獎金。然而,這項足以載入史冊的發現,背後其實是跨越了數十年,充滿曲折、質疑與堅守的科學探索故事,這篇文章就帶大家一起看看三人的傳奇科研經歷。

故事要從上世紀80年代開始說起,
第一位主人公來自日本的坂口志文,
1951年,坂口志文出生在日本滋賀縣,
父親是教授哲學的高中老師,母親則出身醫學世家,
坂口志文從小就對生命和哲學問題充滿好奇,
考入京都大學醫學院後,坂口志文最初想成爲精神病學家,
但是聽了一場關於免疫學“識別自我與非我”的講座後,
坂口志文對免疫學的一個基本問題非常着迷——
免疫系統爲何既能保護我們,又能在某些情況下摧毀我們?
於是,坂口志文決定從此將研究方向轉向免疫學(也就是這次諾獎所表彰的核心領域),嘗試找到背後蘊藏的祕密。

坂口志文
免疫學本身就是一門基礎科學,而且橫跨醫學、生物學等多個領域,
縱觀人類歷史,我們與傳染病的鬥爭,其實就是免疫學的發展史,
18世紀,用牛痘苗來預防天花,開創了人工主動免疫的先河,
到了19世紀,微生物學家路易·巴斯德研製出炭疽疫苗和狂犬病疫苗,
德國學者貝林和北里發現了白喉抗毒素,疫苗堪稱現代醫學最偉大的成就
(這裏多提一句,日本的現代醫學之父北里柴三郎曾在首屆諾獎評選中被提名,
但是受到東大排擠,再加上膚色偏見,最終與諾貝爾獎失之交臂)。
到了上世紀中葉,免疫學進入黃金髮展期,我們在初中的生物課會學習抗體,
高中時期還會詳細學習免疫系統的兩大核心力量——T淋巴細胞和B淋巴細胞,
而這次獲得諾獎的坂口志文正是在T細胞的基礎上(調節性T細胞 Treg)取得突破。

北里柴三郎 1000円
時間回到上世紀70年代,免疫學家Richard Gershon等人首次提出了一個革命性的觀點:
免疫系統中可能存在一種專門負責“踩剎車”的細胞,它們能夠主動抑制免疫反應,
這種說法極具想象力,因爲它確實可以合理解釋免疫系統如何自我調節、避免過度反應。
所以在接下來的十年裏,“抑制性T細胞”(也叫TS細胞)成爲了免疫學研究的寵兒,
無數頂尖實驗室投入其中,科學家們建立了一個龐大而複雜的理論體系,
詳細描述這些細胞如何通過相互作用和分泌可溶性因子來調控免疫系統。
當時,坂口志文在京都大學讀研,他讀到了愛知縣癌症中心西冢泰章教授的一篇論文,
講的是新生小鼠胸腺切除後,會引發自身免疫疾病,
坂口志文敏銳地意識到——胸腺中可能存在某種起着“剎車”作用的細胞,來抑制免疫系統的過度攻擊。

工作細胞-抑制性T細胞
但是隨着分子生物學和單克隆抗體技術的興起,等到坂口志文瞭解到這個領域時,
科學界對“抑制性T細胞”的概念其實普遍持懷疑態度,
一方面研究人員始終無法找到一個穩定、特異的分子標記,
來識別和分離這些所謂的TS細胞,如果找不到研究也是捕風捉影,
而且,等到科研人員掌握了分析T細胞受體(TCR)基因的技術後,
他們發現這些TS細胞似乎沒有功能性的TCR基因重排,
通俗來說,T細胞之所以能精準識別特定病原體,考的就是它表面的一雙“眼睛”TCR,
而科研人員發現那些被懷疑是TS的細胞沒有“眼睛”,
一個“盲人”怎麼可能精準地識別並抑制特定的免疫反應呢?這在邏輯上完全說不通。

另一方面,早期科學家們給“抑制性T細胞”建立了一個龐大複雜的理論體系,
最核心的就是所謂的“I-J”基因,他們認爲是“I-J”基因控制這些“抑制性T細胞”,
等到更先進的分子生物學技術出現後,科學家們再去定位卻發現這個“I-J”基因根本不存在,
所以整個70年代對TS細胞的研究幾乎全都錯了。
於是,科研人員認爲不存在所謂的“抑制性T細胞”,同時提出“中樞耐受”機制,
即胸腺裏那些會攻擊自身的T細胞會通過某種篩選過程清除掉,這個過程就叫中樞耐受。
就這樣,等到坂口志文對“抑制性T細胞”感興趣時,這個領域幾乎以及被判了死刑。
而且要想盡快發論文出成果拿教職,很少有人會在這上面浪費時間,
但爲了深入探究這個在當時非常冷門的假說,坂口志文做出了一個大膽的決定:
他選擇從京都大學研究生院退學,前往愛知縣癌症中心做研究(目前坂口志文爲大阪大學教授)。

浪速醫大原型-阪大醫學部
在愛知縣癌症中心,坂口志文繼續研究西冢泰章教授關於小鼠自身免疫的論文,
這個實驗也相當經典,科學家們一般會切除新生小鼠的胸腺,
胸腺也是T細胞成熟的場所,按照大多數科學家的想法,
切除胸腺會削弱小鼠的免疫力,但是結果卻出人意料,
因爲如果切除新生的小鼠胸腺,它們的免疫系統反而會變得異常活躍,
而且還會瘋狂攻擊自身器官,導致嚴重的自身免疫病。
坂口志文認爲事出反常必有因,這個實驗背後可能隱藏了一種在胸腺中較晚成熟的T細胞,
這類T細胞往往扮演的是“剎車”作用。

西冢泰章
坂口志文的實驗設計也非常精巧,
在發現切除胸腺的小鼠會得自身免疫病後,
他將健康小鼠的成熟T細胞,再注射回這些患病小鼠體內,
結果這些免疫疾病都被抑制了,
這恰恰證明在健康小鼠的成熟T細胞中,確實存在一羣能抑制免疫反應的細胞。
但是,這些可以抑制免疫反應的細胞到底是什麼,
如何從千軍萬馬的免疫細胞中找到它們?
這個任務其實要難得多,足足耗費了坂口志文十多年的心血,
他嘗試了無數種方法來分離和鑑定這些神祕的細胞,直到1995年才終於迎來了突破。

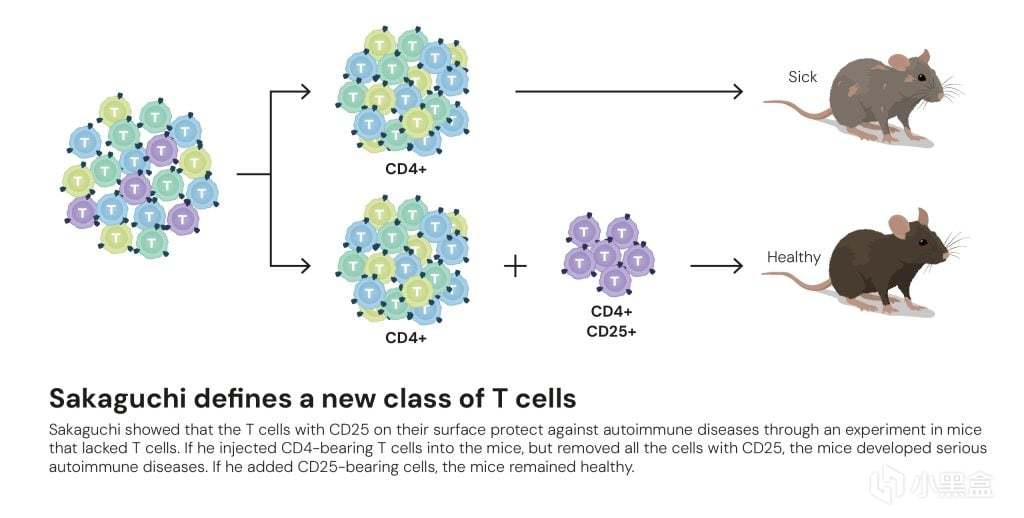
坂口志文先從健康、正常的成年小鼠的淋巴結和脾臟中,
分離出輔助性T細胞(CD4+標記的T細胞),然後利用特異性抗體,
將這羣CD4+細胞中表達白細胞介素-2受體α鏈(CD25+)的一小部分細胞去除,
這樣就得到了兩組細胞,最後將提純後的CD4+和CD25+細胞注射到切除胸腺的小鼠體內,
實驗結果也讓人震驚,接受了CD25+ T細胞的小鼠自發地患上了一系列嚴重的自身免疫病,
這恰恰證明了在正常的T細胞庫中,也普遍存在自身攻擊,只是在正常情況下被某種機制主動地抑制了。
接下來坂口將之前分離出的兩組細胞一同注射到小鼠體內,
結果發現自身免疫病的發生被完全阻止了,而且隨着劑量增加還會加強保護作用,
於是坂口志文將這羣新發現的、具有抑制功能的細胞命名爲“調節性T細胞”(Regulatory T cells, Treg)。
1995年,坂口志文正式將這些研究成果發表在免疫學權威雜誌《Journal of Immunology》上,
按照爽文的脈絡,坂口志文應該會在95年就一炮而紅,但實際並非如此,
90年代,大家仍然認爲不存在所謂的“抑制性T細胞”,
坂口志文接受採訪時說,論文發表後,他自己反而還被“學術界孤立了,完全不受大家歡迎”。
一些科研人員只是把坂口志文的實驗當作一個有趣的“現象”,
要想找到解開“調節性T細胞”的鑰匙,就需要大洋彼岸另外兩位主人公的幫助,
而這把鑰匙,還得從一隻天生體弱多病的小鼠開始說起。

第二個故事始於上世紀40年代的美國橡樹嶺國家實驗室,
這裏當年也是曼哈頓計劃的一部分,研究人員在進行輻射研究時,
偶然發現了一個品系的小鼠,這些雄性小鼠天生皮膚呈鱗屑狀,
脾臟和淋巴結腫大,幾周內便會夭折,看起來非常可憐,
科學家們將其命名爲 scurfy 小鼠,誰也想不到,這些小鼠即將改變整個人類歷程。
早期科研人員認爲,scurfy 小鼠怪病的根源在於 X 染色體上的一個基因突變,
到了90年代分子生物學技術快速進步,怪病的謎底也揭曉,
原來 scurfy 小鼠的免疫系統發生了“叛亂”,它們的T細胞正在瘋狂攻擊自己的身體。

此時,兩位對 scurfy 突變產生濃厚興趣的科學家登場了,
他們是就職於美國 Celltech 生物技術公司的瑪麗·E·布倫科、弗雷德·拉姆斯德爾,
也就是與坂口志文一起分享諾獎的兩位美國科學家。
Celltech專攻開發自身免疫病藥物,兩人敏銳地意識到,
如果能找到導致 scurfy 小鼠發病的那個基因鑰匙,就可能打開理解人類自身免疫病的大門。
於是,他們開始了一項在當時看來如“大海撈針”般的任務:定位 scurfy 突變基因。
那個年代沒有高通量測序,所以需要極大的耐心和創造力,
小鼠的 X 染色體包含約 1.7 億個 DNA 鹼基對,布倫科和拉姆斯德爾運用當時有限的工具,
一步步將搜尋範圍縮小到一段 50 萬個核苷酸的區域,然後對其中的候選基因逐一進行測序和比對。
當他們檢測到第 20 個,也就是最後一個候選基因時,才終於找到了。
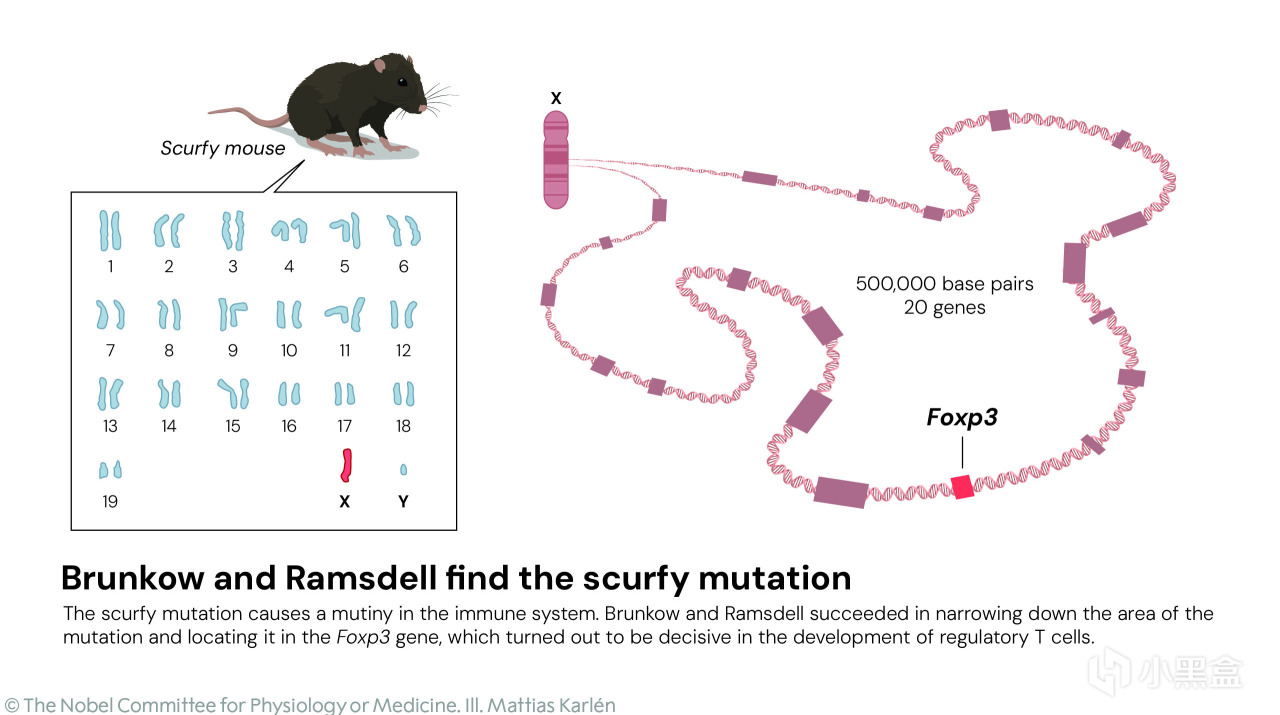
兩人發現 scurfy 小鼠體內一個前所未見的新基因發生了突變,
由於它與一個名爲“叉頭盒基因(forkhead box)”的基因家族相似,所以將其命名爲 Foxp3。
而且他們的發現還有意外之喜,因爲有一種罕見的人類遺傳病IPEX 綜合徵,
這種病的症狀與 scurfy 小鼠驚人地相似,
通過與全球兒科醫生合作,他們獲得了 IPEX 患者的樣本,
兩人最終證實這些男孩體內的 FOXP3 基因(人類同源基因)同樣存在致病性突變。
2001年,兩人將研究成果發表在Nature自然雜誌上,
明確指出 Foxp3 基因的缺陷,是導致 scurfy 小鼠和人類 IPEX 綜合徵的共同元兇。

這篇論文也徹底征服了整個學術界,人們這才發現,
布倫科和拉姆斯德爾的研究,居然可以與坂口志文的工作完美交匯,
全球的實驗室根據兩人的實驗成果加快跟進,很快一個更加清晰的邏輯鏈條浮出水面:
Foxp3 基因,正是調控 Treg 細胞發育和功能的“總開關”!
換句話說,scurfy 小鼠和 IPEX 患者之所以會患上嚴重的自身免疫病,
正是因爲他們體內的 Foxp3 基因發生了突變,導致他們無法產生功能正常的 Treg 細胞,
至此,坂口志文發現的“怪象”,也終於找到了堅實的“機制”作爲支撐,
Treg 細胞的存在和功能被徹底證實,免疫學的一個全新領域由此誕生,
也就是這次諾獎頒獎詞中提到的外周免疫耐受領域 (Peripheral Immune Tolerance)。

到這裏,本文也進入了尾聲,所有的謎題都已解開,
坂口志文通過功能篩選找到的Treg細胞,
恰好就是布倫科和拉姆斯德爾通過基因定位找到的Foxp3,
2003年,坂口志文再次發表論文,將細胞功能與基因調控完美統一,
Foxp3是Treg細胞的靈魂,而Treg細胞是外周免疫耐受的執行者。
接下來的二十年裏,三人的革命性發現仍然在影響全世界,
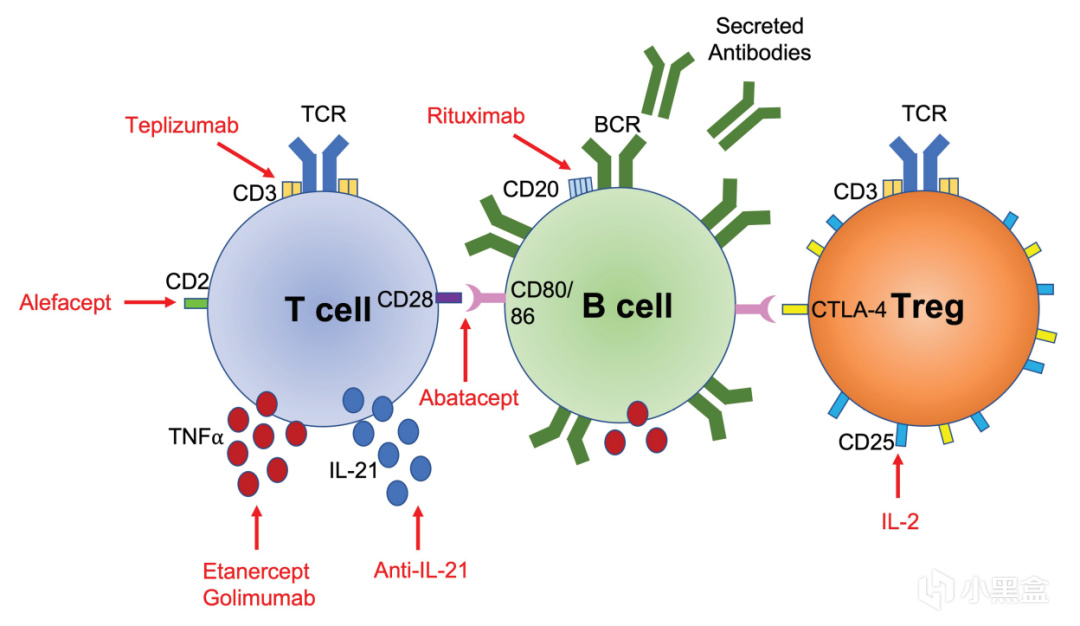
比如在癌症治療中,科學家發現腫瘤會狡猾地吸引大量 Treg 細胞在周圍形成“保護罩”,阻止免疫系統攻擊,
所以科研人員轉而研究開發能移除這些 Treg 細胞的藥物,也就是癌症免疫療法,
在自身免疫病中,思路則完全相反,科研人員嘗試通過注射 IL-2 等因子來增加患者體內的 Treg 細胞,
或在體外大量培養 Treg 細胞再回輸給患者,來抑制過度的免疫反應,
在移植器官時也可以保護自身器官或移植器官免受攻擊。
1型糖尿病-Treg療法
筆者後話:再回顧這些科研經歷, Treg 無疑是一項諾獎級的偉大成就,
坂口志文的經歷其實和去年拿諾獎的AI科學家辛頓類似,
都是在一個已經被叛死刑、不看好的領域(抑制性T細胞、神經網絡)堅持數十年,
等到成果出來(Treg、BP反向傳播),卻並沒有獲得主流學術界的認可,
直到多年後偶然的突破(Foxp3、AlexNet)纔得到印證,
最終對全世界的影響也都極其深遠,
坂口志文的研究給自身免疫病、癌症治療等領域開創先河,
而辛頓的研究也引爆當前的人工智能革命,應用深入各行各業
(AI的發展可以參考往期的辛頓人物誌和老黃髮家史)。
偉大的科學發現,往往始於一個被主流忽視的“萌芽”,
成於數十年如一日做冷板凳的堅守,熬過所有的冷眼,
最終在某個意想不到的時刻,開花結果,改變世界,
當然,這條路上並不可能每一個人都能拿諾獎獲得成功,
科學史是由無數失敗或未達最終目標的研究構築而成的,
每一個被驗證行不通的思路,都爲後人指明瞭正確的方向,
正是因爲有了這些在冷板凳上堅守的探索者,人類知識的邊界才得以持續地、緩慢地向外推進。
全文完。

2023年:
2024年:
更多遊戲資訊請關註:電玩幫遊戲資訊專區
電玩幫圖文攻略 www.vgover.com







![1688人體工學椅不是廣子純爲愛發電[cube_悟空]](https://imgheybox1.max-c.com/bbs/2025/10/06/0fd2d4597215be495aeffdf70dec94b1.jpeg?imageMogr2/auto-orient/ignore-error/1/format/jpg/thumbnail/398x679%3E)





