又到了一年一度的诺奖周,今天是诺奖首日,诺贝尔委员会将生理学或医学奖授予了三位杰出的科学家,分别是来自美国的玛丽·E·布伦科、弗雷德·拉姆斯德尔教授,以及日本的坂口志文教授,三人在外周免疫耐受方面取得突出贡献,获奖者将平分1100万瑞典克朗(约合832万元)奖金。然而,这项足以载入史册的发现,背后其实是跨越了数十年,充满曲折、质疑与坚守的科学探索故事,这篇文章就带大家一起看看三人的传奇科研经历。

故事要从上世纪80年代开始说起,
第一位主人公来自日本的坂口志文,
1951年,坂口志文出生在日本滋贺县,
父亲是教授哲学的高中老师,母亲则出身医学世家,
坂口志文从小就对生命和哲学问题充满好奇,
考入京都大学医学院后,坂口志文最初想成为精神病学家,
但是听了一场关于免疫学“识别自我与非我”的讲座后,
坂口志文对免疫学的一个基本问题非常着迷——
免疫系统为何既能保护我们,又能在某些情况下摧毁我们?
于是,坂口志文决定从此将研究方向转向免疫学(也就是这次诺奖所表彰的核心领域),尝试找到背后蕴藏的秘密。

坂口志文
免疫学本身就是一门基础科学,而且横跨医学、生物学等多个领域,
纵观人类历史,我们与传染病的斗争,其实就是免疫学的发展史,
18世纪,用牛痘苗来预防天花,开创了人工主动免疫的先河,
到了19世纪,微生物学家路易·巴斯德研制出炭疽疫苗和狂犬病疫苗,
德国学者贝林和北里发现了白喉抗毒素,疫苗堪称现代医学最伟大的成就
(这里多提一句,日本的现代医学之父北里柴三郎曾在首届诺奖评选中被提名,
但是受到东大排挤,再加上肤色偏见,最终与诺贝尔奖失之交臂)。
到了上世纪中叶,免疫学进入黄金发展期,我们在初中的生物课会学习抗体,
高中时期还会详细学习免疫系统的两大核心力量——T淋巴细胞和B淋巴细胞,
而这次获得诺奖的坂口志文正是在T细胞的基础上(调节性T细胞 Treg)取得突破。

北里柴三郎 1000円
时间回到上世纪70年代,免疫学家Richard Gershon等人首次提出了一个革命性的观点:
免疫系统中可能存在一种专门负责“踩刹车”的细胞,它们能够主动抑制免疫反应,
这种说法极具想象力,因为它确实可以合理解释免疫系统如何自我调节、避免过度反应。
所以在接下来的十年里,“抑制性T细胞”(也叫TS细胞)成为了免疫学研究的宠儿,
无数顶尖实验室投入其中,科学家们建立了一个庞大而复杂的理论体系,
详细描述这些细胞如何通过相互作用和分泌可溶性因子来调控免疫系统。
当时,坂口志文在京都大学读研,他读到了爱知县癌症中心西冢泰章教授的一篇论文,
讲的是新生小鼠胸腺切除后,会引发自身免疫疾病,
坂口志文敏锐地意识到——胸腺中可能存在某种起着“刹车”作用的细胞,来抑制免疫系统的过度攻击。

工作细胞-抑制性T细胞
但是随着分子生物学和单克隆抗体技术的兴起,等到坂口志文了解到这个领域时,
科学界对“抑制性T细胞”的概念其实普遍持怀疑态度,
一方面研究人员始终无法找到一个稳定、特异的分子标记,
来识别和分离这些所谓的TS细胞,如果找不到研究也是捕风捉影,
而且,等到科研人员掌握了分析T细胞受体(TCR)基因的技术后,
他们发现这些TS细胞似乎没有功能性的TCR基因重排,
通俗来说,T细胞之所以能精准识别特定病原体,考的就是它表面的一双“眼睛”TCR,
而科研人员发现那些被怀疑是TS的细胞没有“眼睛”,
一个“盲人”怎么可能精准地识别并抑制特定的免疫反应呢?这在逻辑上完全说不通。

另一方面,早期科学家们给“抑制性T细胞”建立了一个庞大复杂的理论体系,
最核心的就是所谓的“I-J”基因,他们认为是“I-J”基因控制这些“抑制性T细胞”,
等到更先进的分子生物学技术出现后,科学家们再去定位却发现这个“I-J”基因根本不存在,
所以整个70年代对TS细胞的研究几乎全都错了。
于是,科研人员认为不存在所谓的“抑制性T细胞”,同时提出“中枢耐受”机制,
即胸腺里那些会攻击自身的T细胞会通过某种筛选过程清除掉,这个过程就叫中枢耐受。
就这样,等到坂口志文对“抑制性T细胞”感兴趣时,这个领域几乎以及被判了死刑。
而且要想尽快发论文出成果拿教职,很少有人会在这上面浪费时间,
但为了深入探究这个在当时非常冷门的假说,坂口志文做出了一个大胆的决定:
他选择从京都大学研究生院退学,前往爱知县癌症中心做研究(目前坂口志文为大阪大学教授)。

浪速医大原型-阪大医学部
在爱知县癌症中心,坂口志文继续研究西冢泰章教授关于小鼠自身免疫的论文,
这个实验也相当经典,科学家们一般会切除新生小鼠的胸腺,
胸腺也是T细胞成熟的场所,按照大多数科学家的想法,
切除胸腺会削弱小鼠的免疫力,但是结果却出人意料,
因为如果切除新生的小鼠胸腺,它们的免疫系统反而会变得异常活跃,
而且还会疯狂攻击自身器官,导致严重的自身免疫病。
坂口志文认为事出反常必有因,这个实验背后可能隐藏了一种在胸腺中较晚成熟的T细胞,
这类T细胞往往扮演的是“刹车”作用。

西冢泰章
坂口志文的实验设计也非常精巧,
在发现切除胸腺的小鼠会得自身免疫病后,
他将健康小鼠的成熟T细胞,再注射回这些患病小鼠体内,
结果这些免疫疾病都被抑制了,
这恰恰证明在健康小鼠的成熟T细胞中,确实存在一群能抑制免疫反应的细胞。
但是,这些可以抑制免疫反应的细胞到底是什么,
如何从千军万马的免疫细胞中找到它们?
这个任务其实要难得多,足足耗费了坂口志文十多年的心血,
他尝试了无数种方法来分离和鉴定这些神秘的细胞,直到1995年才终于迎来了突破。

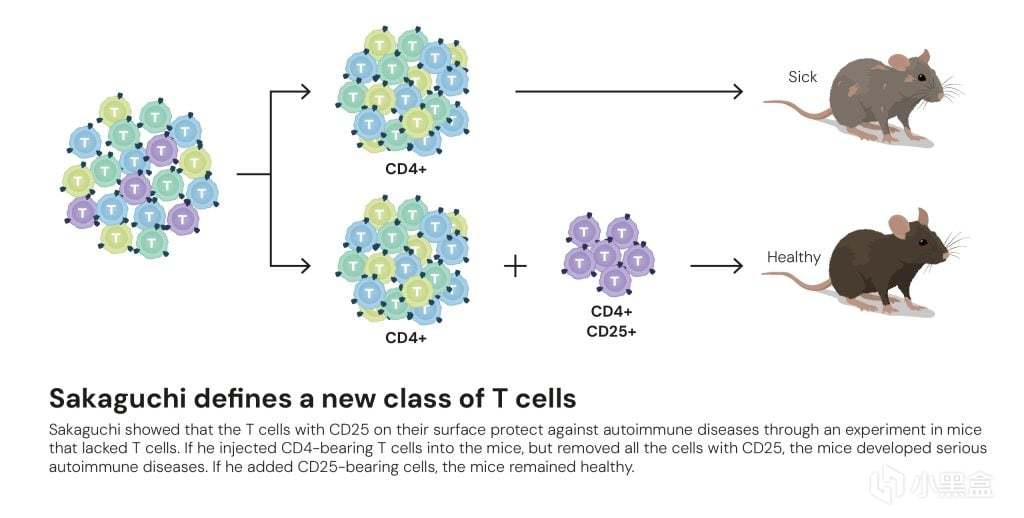
坂口志文先从健康、正常的成年小鼠的淋巴结和脾脏中,
分离出辅助性T细胞(CD4+标记的T细胞),然后利用特异性抗体,
将这群CD4+细胞中表达白细胞介素-2受体α链(CD25+)的一小部分细胞去除,
这样就得到了两组细胞,最后将提纯后的CD4+和CD25+细胞注射到切除胸腺的小鼠体内,
实验结果也让人震惊,接受了CD25+ T细胞的小鼠自发地患上了一系列严重的自身免疫病,
这恰恰证明了在正常的T细胞库中,也普遍存在自身攻击,只是在正常情况下被某种机制主动地抑制了。
接下来坂口将之前分离出的两组细胞一同注射到小鼠体内,
结果发现自身免疫病的发生被完全阻止了,而且随着剂量增加还会加强保护作用,
于是坂口志文将这群新发现的、具有抑制功能的细胞命名为“调节性T细胞”(Regulatory T cells, Treg)。
1995年,坂口志文正式将这些研究成果发表在免疫学权威杂志《Journal of Immunology》上,
按照爽文的脉络,坂口志文应该会在95年就一炮而红,但实际并非如此,
90年代,大家仍然认为不存在所谓的“抑制性T细胞”,
坂口志文接受采访时说,论文发表后,他自己反而还被“学术界孤立了,完全不受大家欢迎”。
一些科研人员只是把坂口志文的实验当作一个有趣的“现象”,
要想找到解开“调节性T细胞”的钥匙,就需要大洋彼岸另外两位主人公的帮助,
而这把钥匙,还得从一只天生体弱多病的小鼠开始说起。

第二个故事始于上世纪40年代的美国橡树岭国家实验室,
这里当年也是曼哈顿计划的一部分,研究人员在进行辐射研究时,
偶然发现了一个品系的小鼠,这些雄性小鼠天生皮肤呈鳞屑状,
脾脏和淋巴结肿大,几周内便会夭折,看起来非常可怜,
科学家们将其命名为 scurfy 小鼠,谁也想不到,这些小鼠即将改变整个人类历程。
早期科研人员认为,scurfy 小鼠怪病的根源在于 X 染色体上的一个基因突变,
到了90年代分子生物学技术快速进步,怪病的谜底也揭晓,
原来 scurfy 小鼠的免疫系统发生了“叛乱”,它们的T细胞正在疯狂攻击自己的身体。

此时,两位对 scurfy 突变产生浓厚兴趣的科学家登场了,
他们是就职于美国 Celltech 生物技术公司的玛丽·E·布伦科、弗雷德·拉姆斯德尔,
也就是与坂口志文一起分享诺奖的两位美国科学家。
Celltech专攻开发自身免疫病药物,两人敏锐地意识到,
如果能找到导致 scurfy 小鼠发病的那个基因钥匙,就可能打开理解人类自身免疫病的大门。
于是,他们开始了一项在当时看来如“大海捞针”般的任务:定位 scurfy 突变基因。
那个年代没有高通量测序,所以需要极大的耐心和创造力,
小鼠的 X 染色体包含约 1.7 亿个 DNA 碱基对,布伦科和拉姆斯德尔运用当时有限的工具,
一步步将搜寻范围缩小到一段 50 万个核苷酸的区域,然后对其中的候选基因逐一进行测序和比对。
当他们检测到第 20 个,也就是最后一个候选基因时,才终于找到了。
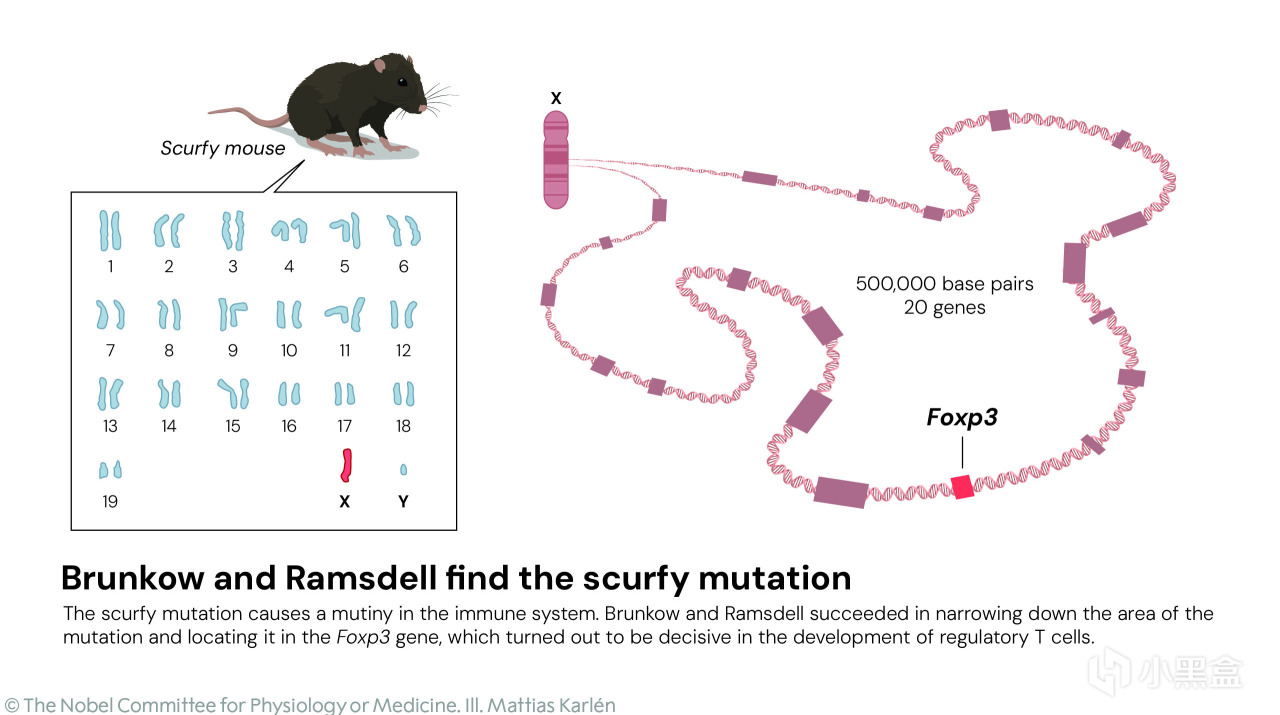
两人发现 scurfy 小鼠体内一个前所未见的新基因发生了突变,
由于它与一个名为“叉头盒基因(forkhead box)”的基因家族相似,所以将其命名为 Foxp3。
而且他们的发现还有意外之喜,因为有一种罕见的人类遗传病IPEX 综合征,
这种病的症状与 scurfy 小鼠惊人地相似,
通过与全球儿科医生合作,他们获得了 IPEX 患者的样本,
两人最终证实这些男孩体内的 FOXP3 基因(人类同源基因)同样存在致病性突变。
2001年,两人将研究成果发表在Nature自然杂志上,
明确指出 Foxp3 基因的缺陷,是导致 scurfy 小鼠和人类 IPEX 综合征的共同元凶。

这篇论文也彻底征服了整个学术界,人们这才发现,
布伦科和拉姆斯德尔的研究,居然可以与坂口志文的工作完美交汇,
全球的实验室根据两人的实验成果加快跟进,很快一个更加清晰的逻辑链条浮出水面:
Foxp3 基因,正是调控 Treg 细胞发育和功能的“总开关”!
换句话说,scurfy 小鼠和 IPEX 患者之所以会患上严重的自身免疫病,
正是因为他们体内的 Foxp3 基因发生了突变,导致他们无法产生功能正常的 Treg 细胞,
至此,坂口志文发现的“怪象”,也终于找到了坚实的“机制”作为支撑,
Treg 细胞的存在和功能被彻底证实,免疫学的一个全新领域由此诞生,
也就是这次诺奖颁奖词中提到的外周免疫耐受领域 (Peripheral Immune Tolerance)。

到这里,本文也进入了尾声,所有的谜题都已解开,
坂口志文通过功能筛选找到的Treg细胞,
恰好就是布伦科和拉姆斯德尔通过基因定位找到的Foxp3,
2003年,坂口志文再次发表论文,将细胞功能与基因调控完美统一,
Foxp3是Treg细胞的灵魂,而Treg细胞是外周免疫耐受的执行者。
接下来的二十年里,三人的革命性发现仍然在影响全世界,
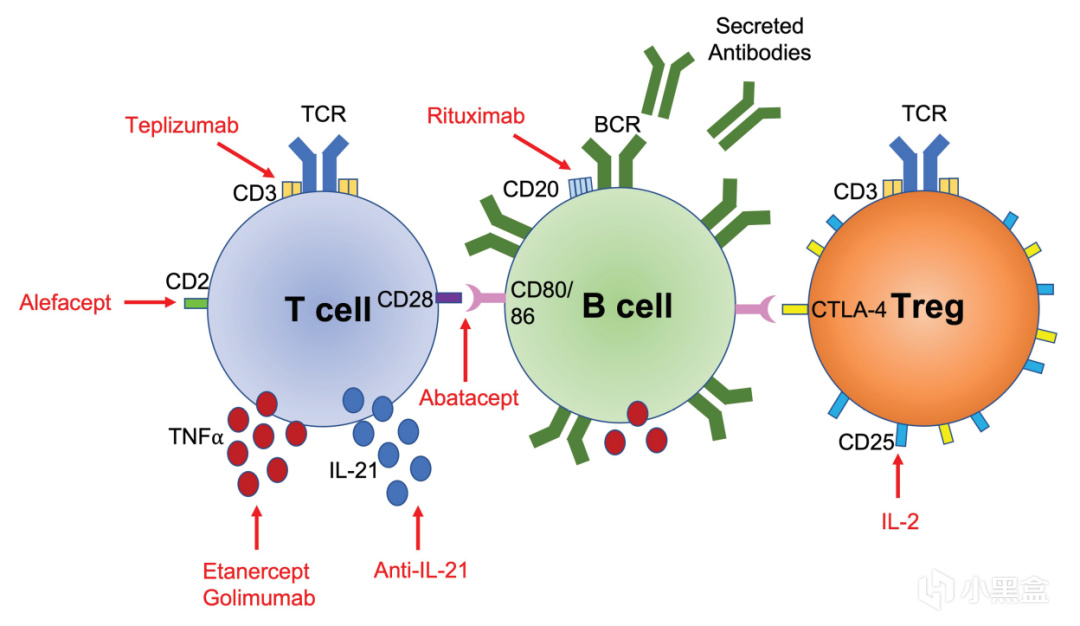
比如在癌症治疗中,科学家发现肿瘤会狡猾地吸引大量 Treg 细胞在周围形成“保护罩”,阻止免疫系统攻击,
所以科研人员转而研究开发能移除这些 Treg 细胞的药物,也就是癌症免疫疗法,
在自身免疫病中,思路则完全相反,科研人员尝试通过注射 IL-2 等因子来增加患者体内的 Treg 细胞,
或在体外大量培养 Treg 细胞再回输给患者,来抑制过度的免疫反应,
在移植器官时也可以保护自身器官或移植器官免受攻击。
1型糖尿病-Treg疗法
笔者后话:再回顾这些科研经历, Treg 无疑是一项诺奖级的伟大成就,
坂口志文的经历其实和去年拿诺奖的AI科学家辛顿类似,
都是在一个已经被叛死刑、不看好的领域(抑制性T细胞、神经网络)坚持数十年,
等到成果出来(Treg、BP反向传播),却并没有获得主流学术界的认可,
直到多年后偶然的突破(Foxp3、AlexNet)才得到印证,
最终对全世界的影响也都极其深远,
坂口志文的研究给自身免疫病、癌症治疗等领域开创先河,
而辛顿的研究也引爆当前的人工智能革命,应用深入各行各业
(AI的发展可以参考往期的辛顿人物志和老黄发家史)。
伟大的科学发现,往往始于一个被主流忽视的“萌芽”,
成于数十年如一日做冷板凳的坚守,熬过所有的冷眼,
最终在某个意想不到的时刻,开花结果,改变世界,
当然,这条路上并不可能每一个人都能拿诺奖获得成功,
科学史是由无数失败或未达最终目标的研究构筑而成的,
每一个被验证行不通的思路,都为后人指明了正确的方向,
正是因为有了这些在冷板凳上坚守的探索者,人类知识的边界才得以持续地、缓慢地向外推进。
全文完。

2023年:
2024年:
更多游戏资讯请关注:电玩帮游戏资讯专区
电玩帮图文攻略 www.vgover.com







![1688人体工学椅不是广子纯为爱发电[cube_悟空]](https://imgheybox1.max-c.com/bbs/2025/10/06/0fd2d4597215be495aeffdf70dec94b1.jpeg?imageMogr2/auto-orient/ignore-error/1/format/jpg/thumbnail/398x679%3E)




